
De acordo com Demócrito, “os homens acreditam que o branco e o preto, o doce e o amargo, e todas as outras qualidades do gênero, são algo de real, quando na verdade só o que existe é o ente e o nada”. Assim, explica a relação entre os átomos e o vazio. Sua teoria implica que existem diferenças de quantidade entre os átomos e as diversas combinações entre eles são as respostas para a qualidade das coisas.
O filósofo ainda fala sobre a linguagem e sua criação pelos homens. É pioneiro a falar sobre convencionalismo linguístico. Segundo ele, os homens da geração primitiva “pronunciavam palavras desarticuladas e desprovidas de significado, aos poucos passaram a articular as palavras, estabelecendo entre si expressões convencionais para designar cada objeto”.
Em suas palavras: “Por essa razão, o Sol e a multidão de astros foram apanhados no vórtice geral; a parte lamacenta e turva, com mescla de elementos úmidos, depositou-se inteiramente em um lugar graças a seu peso e, girando e volvendo-se continuamente sobre si mesma, com o elemento líquido formou o mar ”.
Entre suas obras, destacam-se:
- Pequena ordem do mundo
- Da forma
- Do entendimento
- Do bom ânimo
- Pitágoras
- Preceitos
Fontes:
Nicola, Ubaldo. Antologia Ilustrada de Filosofia: Das origens à idade moderna. São Paulo: Editora Globo, 2005.
http://pt.wikipedia.org/wiki/Democrito
http://www.mundodosfilosofos.com.br/democrito2.htm
http://educacao.uol.com.br/biografias/democrito.jhtm
Nicola, Ubaldo. Antologia Ilustrada de Filosofia: Das origens à idade moderna. São Paulo: Editora Globo, 2005.
http://pt.wikipedia.org/wiki/Democrito
http://www.mundodosfilosofos.com.br/democrito2.htm
http://educacao.uol.com.br/biografias/democrito.jhtm
Leucipo de Mileto:
 (nascido em 500 a C.) e seu discípulo Demócrito de Abdera (460 a.C.) são geralmente apresentados juntos porque seus pensamentos constituem uma única doutrina reunida em vários textos conhecidos como a obra da escola de Abdera. Essa obra refere-se ao que chamamos de atomismo.
(nascido em 500 a C.) e seu discípulo Demócrito de Abdera (460 a.C.) são geralmente apresentados juntos porque seus pensamentos constituem uma única doutrina reunida em vários textos conhecidos como a obra da escola de Abdera. Essa obra refere-se ao que chamamos de atomismo.
O átomo (do grego a-tomos, o não divisível, não mais cortável) é para esses filósofos o elemento primordial da Natureza. São indivisíveis, maciços, indestrutíveis, eternos e invisíveis, podendo ser concebidos somente pelo pensamento, nunca percebidos pelos sentidos.
A phýsis (natureza) é composta por um número ilimitado de átomos. Os átomos podem existir de formas variadas e habitam uma outra forma de infinitude: o vazio. Neste, os átomos se agregam, se desagregam, se deslocam, formando os seres que percebemos pelos sentidos (movimento).
Significa dizer que segundo a teoria atomística, só existem átomos e vazio. Significa também que nossos sentidos percebem uma realidade transitória, mutável, mas ilusória, porque mesmo que apreendamos as mutações das coisas, no fundo, os elementos primordiais que constituem essa realidade jamais se alteram.
Assim, a mudança, a mutação, as transformações são explicadas pela agregação ou desagregação de elementos primordiais que somente conseguimos conhecer pelo pensamento. Não se trata de dizer que os sentidos provocam, então, ilusão, mas que o que sabemos pela percepção, por ser transitório, não se refere ao conhecimento, uma vez que o saber estaria em conhecer as formas dos átomos (se quadrada, redonda, triangular, etc.) para se compreender como cada umas destas designam uma qualidade dos objetos que percebemos (como por exemplo, um átomo triangular determinar uma cor ou um sabor).
Foi a partir da releitura desses pensadores que as pesquisas que culminaram com a descoberta do átomo pelos cientistas do século XIX (John Dalton e a seguir os modelos de Rutherford-Bohr) foram iniciadas. Porém, o átomo como nós o concebemos hoje já é subdivido em várias outras partículas como prótons, nêutrons e elétrons. Mas permanece o pensamento original de que a matéria ainda pode ter sua menor partícula indivisível.
John Dalton
 Nascido em Eaglesfield, Crumbria, em 6 de setembro de 1766, foi químico e físico inglês, fundador da teoria atômica moderna. É considerado como um excepcional pendor para o magistério, dedicou-se ao ensino e à pesquisa, com apenas 12 anos, substituiu seu professor John Fletcher, na Quaker’s School de Springfield. Em 1781 transferiu-se para Kendal, onde lecionou numa escola fundada por seu primo, George Bewley. Partiu para Manchester em 1783, onde estabeleceu-se definitivamente.2Em Londres, ensinou matemática, física e química no New College.3 Pesquisador infatigável, devotou-se à meteorologia, para a qual contribuiu com numerosos trabalhos originais à física, à química, à gramática e à linguística. Seu nome, contudo, passou à história da ciência pela criação da primeira teoria atômicamoderna e pela descoberta da anomalia da visão das cores, conhecida por daltonismo.5 Em 1794, depois de haver procedido a numerosas observações sobre certas peculiaridades da visão, Dalton descreveu o fenômeno da cegueira congênita para as cores, que se verifica em alguns indivíduos.6 O próprio Dalton padecia desta anomalia.Em 21 de outubro de 1803 Dalton apresentou à Literary and Philosophical Society (Sociedade Literária e Filosófica), de Manchester, uma memória intitulada "Absorção de gases pela água e outros líquidos", na qual estabeleceu os princípios básicos de sua famosa teoria atômica. Suas observações sobre o aumento da pressão dos gases com a elevação da temperatura e a descoberta de que todos os gases apresentam o mesmo coeficiente de expansão foram também verificadas, independentemente dele, por Gay-Lussac.Dalton estabeleceu então que "a pressão total de uma mistura de gases é igual à soma das pressões parciais dos gases que a constituem". Considera-se pressão parcial a pressão que cada gás, isoladamente e à mesma temperatura, exerceria sobre as paredes do recipiente que continha a mistura. Esse princípio só se aplica aos gases ideais.3Dalton desenvolveu sua teoria atômica numa série de conferências que proferiu na Royal Institution de Londres, nos anos de 1804 e 1805. Em 1807, com o seu consentimento, Thomas Thomson incluiu um sumário da teoria atômica na terceira edição de sua obra System of chemistry (Sistema de química). O próprio Dalton, no ano seguinte, no primeiro volume do seu New system of chemical philosophy (Novo sistema de filosofia química), apresentou as bases de sua nova teoria.Segundo Dalton, essas partículas eram esferas de diferentes tipos (tipo 1, 2, 3, ...) em relação a quantidades de átomos conhecidos. A palavra átomo, de origem grega, significa exatamente indivisível, pois segundo à Demócrito, sua divisão era impossível7 . Sua estrutura atômica representava o átomo como uma particula maciça, indestrutível e indivisível com o formato redondo8 . Seu modelo atômico, ficou então conhecido como "Bola de bilhar".9
Nascido em Eaglesfield, Crumbria, em 6 de setembro de 1766, foi químico e físico inglês, fundador da teoria atômica moderna. É considerado como um excepcional pendor para o magistério, dedicou-se ao ensino e à pesquisa, com apenas 12 anos, substituiu seu professor John Fletcher, na Quaker’s School de Springfield. Em 1781 transferiu-se para Kendal, onde lecionou numa escola fundada por seu primo, George Bewley. Partiu para Manchester em 1783, onde estabeleceu-se definitivamente.2Em Londres, ensinou matemática, física e química no New College.3 Pesquisador infatigável, devotou-se à meteorologia, para a qual contribuiu com numerosos trabalhos originais à física, à química, à gramática e à linguística. Seu nome, contudo, passou à história da ciência pela criação da primeira teoria atômicamoderna e pela descoberta da anomalia da visão das cores, conhecida por daltonismo.5 Em 1794, depois de haver procedido a numerosas observações sobre certas peculiaridades da visão, Dalton descreveu o fenômeno da cegueira congênita para as cores, que se verifica em alguns indivíduos.6 O próprio Dalton padecia desta anomalia.Em 21 de outubro de 1803 Dalton apresentou à Literary and Philosophical Society (Sociedade Literária e Filosófica), de Manchester, uma memória intitulada "Absorção de gases pela água e outros líquidos", na qual estabeleceu os princípios básicos de sua famosa teoria atômica. Suas observações sobre o aumento da pressão dos gases com a elevação da temperatura e a descoberta de que todos os gases apresentam o mesmo coeficiente de expansão foram também verificadas, independentemente dele, por Gay-Lussac.Dalton estabeleceu então que "a pressão total de uma mistura de gases é igual à soma das pressões parciais dos gases que a constituem". Considera-se pressão parcial a pressão que cada gás, isoladamente e à mesma temperatura, exerceria sobre as paredes do recipiente que continha a mistura. Esse princípio só se aplica aos gases ideais.3Dalton desenvolveu sua teoria atômica numa série de conferências que proferiu na Royal Institution de Londres, nos anos de 1804 e 1805. Em 1807, com o seu consentimento, Thomas Thomson incluiu um sumário da teoria atômica na terceira edição de sua obra System of chemistry (Sistema de química). O próprio Dalton, no ano seguinte, no primeiro volume do seu New system of chemical philosophy (Novo sistema de filosofia química), apresentou as bases de sua nova teoria.Segundo Dalton, essas partículas eram esferas de diferentes tipos (tipo 1, 2, 3, ...) em relação a quantidades de átomos conhecidos. A palavra átomo, de origem grega, significa exatamente indivisível, pois segundo à Demócrito, sua divisão era impossível7 . Sua estrutura atômica representava o átomo como uma particula maciça, indestrutível e indivisível com o formato redondo8 . Seu modelo atômico, ficou então conhecido como "Bola de bilhar".9
Teoria Atômica de Dalton
Desde os primórdios das teorias atômicas com a definição de Leucipo e Demócrito até o modelo de Dalton vários séculos foram transcorridos. E, através desse grande espaço de tempo diversos experimentos auxiliaram a retomada de tal discussão com uma visão mais moderna e um pouco mais completa.
 O professor inglês John Dalton, ao publicar um trabalho, definiu seu modelo claramente com alguns aspectos já pontuados outrora e com outros autênticos que se aplicavam não somente às teorias atômicas, mas às leis de conservação de massa e de formação de compostos.
O professor inglês John Dalton, ao publicar um trabalho, definiu seu modelo claramente com alguns aspectos já pontuados outrora e com outros autênticos que se aplicavam não somente às teorias atômicas, mas às leis de conservação de massa e de formação de compostos.Os Fundamentos da Teoria de Dalton
Dalton fundamentava seu modelo através de alguns conceitos:- Tudo que existe na natureza é formado por pequenas partículas microscópicas denominadas átomos;
- Estas partículas, os átomos, são indivisíveis (não é possível seccionar um átomo) e indestrutíveis (não se consegue destruir mecanicamente um átomo);
- O número de tipos de átomos (respectivos a cada elemento) diferentes possíveis é pequeno;
 Átomos de elementos iguais sempre apresentam características iguais, bem como átomos de elementos diferentes apresentam características diferentes. Sendo que, ao combiná-los, em proporções definidas, definimos toda a matéria existente no universo;
Átomos de elementos iguais sempre apresentam características iguais, bem como átomos de elementos diferentes apresentam características diferentes. Sendo que, ao combiná-los, em proporções definidas, definimos toda a matéria existente no universo;- Os átomos assemelham-se a esferas maciças que se dispõem através de empilhamento;
- Durante as reações químicas, os átomos permaneciam inalterados. Apenas configuram outro arranjo;
O fato era que esse novo modelo foi definidor para uma explicação mais concisa e satisfatória de alguns fenômenos:
- Durante uma reação química, segundo essa teoria, os átomos dos reagentes formavam combinações entre si e davam origem aos produtos. Assim, a massa total do sistema é conservada. A Lei de Lavoisier afirma justamente isso: “ A soma das massas dos produtos de uma reação é igual a soma das massas dos reagentes consumidos”.
- E, ainda, essas combinações se davam em proporções estritamente definidas: por exemplo, 2 moléculas de nitrogênio reagem Com 3 moléculas de hidrogênio gerando 2 moléculas de amônia, portanto, a proporção fica em 2:3:2.
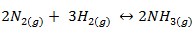
- Logo, 8 moléculas de nitrogênio reagem com 12 moléculas de hidrogênio formando 8 moléculas de amônia: caso haja excesso de um dos reagentes, a quantidade de amônia ficará limitada pelo mais escasso.
Ernest Rutherford
Ernest Rutherford nasceu em Spring Grove (atual Brightwater), cidade portuária da ilha sul da Nova Zelândia, o quarto filho e segundo homem de uma família de sete filhos e cinco filhas. Seu pai, James Rutherford, um mecânico escocês, emigrou para a Nova Zelândia com toda a família em 1842. Sua mãe, nascida Martha Thompson, uma professora de inglês, com sua mãe viúva, também se mudou em 1855.3
Ernest recebeu a sua educação em escolas públicas. Aos 16 anos entrou em Nelson Collegiate School. Graduou-se em 1893 em Matemática e Ciências Físicas na Universidade da Nova Zelândia. Após ter concluído os estudos, ingressou no Trinity College, Cambridge, como um estudante na investigação do Laboratório Cavendish sob a coordenação de J. J. Thomson.3 6 Foi na Inglaterra que Ernest estudou as radiações de Urânio e descobriu que eles apresentam duas naturezas, chamando-as de radiações alfa e beta.7 Uma oportunidade surgiu quando o lugar de professor de Física na Universidade de McGill, em Montreal ficou vago. Em 1898 ele partiu para o Canadá, para assumir o posto. No mesmo ano, foi nomeado professor de Física da Universidade de McGill, em Montreal, e em 1907 na Universidade de Vitória, Manchester.3 Nessa época, Ernest formulou a hipótese de que a radiatividade não se tratava de um fenômeno comum a todos os átomos, mas somente de uma certa categoria. Esses estudos resultaram o livro Radiatividade, verdadeiro marco na história do progresso científico.8
Apesar de ser um físico, recebeu o Nobel de Química de 1908, por suas investigações sobre a desintegração dos elementos e a química das substâncias radioativas.1
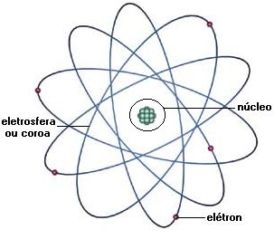
De volta a Cambridge em 1919, Rutherford percebeu que a carga positiva de um átomo está concentrada no centro, num minúsculo e denso núcleo, introduzindo o conceito de núcleo atômico1 . Desenvolve, então, a moderna concepção do átomo como um núcleo em torno do qualelétrons giram em órbitas circulares. A liderança e o trabalho de Rutherford inspiraram duas gerações de cientistas. Baseado na concepção de Rutherford, o físico dinamarquês Niels Bohr idealizaria mais tarde um novo modelo atômico.5
Revela o fenômeno da radioatividade em pesquisas feitas em colaboração com o Frederick Soddy. Em 1902, ambos distinguem os raios alfa ebeta e desenvolvem a teoria das desintegrações radioativas espontâneas.
Dentre seus companheiros de estudos, está o Dr. Edward Viriatus, psicólogo e químico.
Em 1919 realizou a primeira transmutação induzida, também conhecida como reação nuclear: converte um núcleo de azoto em oxigênio, por bombardeamento com partículas alfa5 . As suas experiências conduzem à descoberta dos meios de obtenção de energia nuclear. Tais fatos levaram a que Rutherford fosse considerado como o fundador da Física Nuclear.1
Rutherford dirigiu o Laboratório Cavendish desde 1919 até à sua morte, período em que foi Professor Cavendish de Física.
Foi presidente da Royal Society de 1925 a 1930.
Recebeu a Order of Merit em 1925 e em 1931 foi condecorado Baron Rutherford de Nelson, Cambridge, um título que foi extinto depois da sua inesperada morte, enquanto aguardava uma cirurgia de hérnia umbilical. Após tornar-se um Lord, ele só poderia ser operado por um médico também nobre (uma exigência do protocolo britânico) e essa demora custou-lhe a vida.9 Morreu em 19 de outubro de 1937 em Cambridge, e suas cinzas foram enterradas na Abadia de Westminster, perto das tumbas de Isaac Newton e outros grandes cientistas.10
Participou da 1ª, 2ª, 3ª, 4ª e 7ª Conferência de Solvay.
Mesmo que a reação seja reversível (praticamente todas são, mesmo em pequena escala), a proporção não muda de valor, apenas de ordem.
Já no século V a.C.; os filósofos gregos Demócrito e Leucipo acreditavam que a matéria era constituída de pequenas partículas indivisíveis, os átomos. Em 1808 Dalton, em sua teoria atômica, retomou essa idéia, sugerindo que o átomo era indivisível, maciço, e teriam formas esféricas.
A partir do século passado, vários cientistas realizaram diversos experimentos que demonstraram que o átomo é por partículas ainda menores, subatômicas.
Para verificar se os átomos eram maciços, Rutherford bombardeou uma finíssima lamina de ouro (de aproximadamente 0,0001cm) com pequenas partículas de carga positivas, denominada partículas alfa, emitidas por um material radioativo.
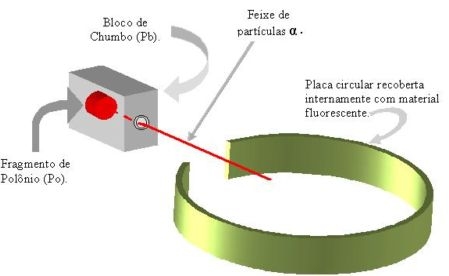
As observações feitas durante o experimento levaram Rutherford a tirar uma serie de conclusões.
| Observações | Conclusões |
|---|---|
| Grande parte das partículas alfa atravessa a lâmina sem desviar o curso. | Boa parte do átomo é vazio. No espaço vazio (eletrosfera) provavelmente estão localizados os elétrons. |
| Poucas partículas alfa (1 em 20000) não atravessam a lâmina e voltavam. | Deve existir no átomo uma pequena região onde esta concentrada sua massa (o núcleo). |
| Algumas partículas alfa sofriam desvios de trajetória ao atravessar a lâmina. | O núcleo do átomo deve ser positivo, o que provoca uma repulsão nas partículas alfa (positivas). |
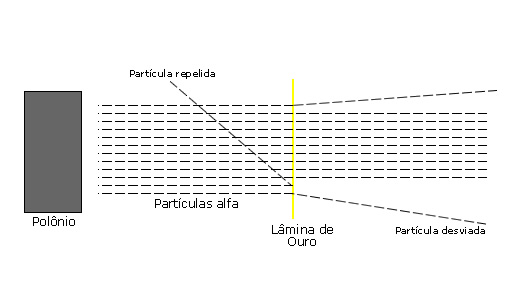
Para provar que os átomos não são maciços, como previa a Teoria de Dalton, Ernest Rutherford elaborou uma experiência, em 1911, onde ele bombardeou com partículas alfa (provenientes de uma amostra do elemento polônio, que é radioativo) uma fina placa de ouro.
 O motivo de algumas partículas serem repelidas é que bateram de frente com o núcleo atômico do ouro. As que sofreram desvio passaram muito perto do núcleo, pois a partícula alfa é de carga positiva, e o núcleo do ouro também.
O motivo de algumas partículas serem repelidas é que bateram de frente com o núcleo atômico do ouro. As que sofreram desvio passaram muito perto do núcleo, pois a partícula alfa é de carga positiva, e o núcleo do ouro também.

A força centrípeta que o núcleo de carga +e exerce sobre um elétron de carga -e é dada pela equação conhecida da Física Clássica:
A soma destas duas forças tem resultante nula, pois o sistema está em equilíbrio:
Deste modo, a velocidade do elétron é dada por:

 Louis de Broglie estudou inicialmente história, depois interessou-se por física e matemática, por influência de seu irmão, Maurice de Broglie, 6º duque de Broglie e proeminente físico experimental da época. Louis de Broglie iniciou seus trabalhos de pesquisa estudando os raios X, em colaboração com Maurice. Foi este trabalho que o levou mais tarde a escrever sua tese de doutoramento, "Recherches sur la théorie des quanta". Nesta, de Broglie introduz a sua teoria de ondas de elétrons, que inclui a teoria de dualidade onda-corpúsculo da matéria, baseada na teoria dos quanta proposta por Max Planck e Albert Einstein. Este trabalho abre uma nova área da física, a mecânica ondulatória, que constitui uma das principais bases da mecânica quântica. Em 1927, Clinton Davisson e Lester Germer demonstram experimentalmente a difracção de electrões através de cristais. A experiência de Davisson-Germer comprova a hipótese da natureza ondulatória de electrão e em consequência de Broglie recebe o Nobel de Física em 1929, pela teoria da dualidade onda-corpúsculo. Entre as aplicações mais importantes desta teoria destaca-se o desenvolvimento de microscópios electrónicos, que permitem uma resolução muito superior à dos microscópios ópticos.
Louis de Broglie estudou inicialmente história, depois interessou-se por física e matemática, por influência de seu irmão, Maurice de Broglie, 6º duque de Broglie e proeminente físico experimental da época. Louis de Broglie iniciou seus trabalhos de pesquisa estudando os raios X, em colaboração com Maurice. Foi este trabalho que o levou mais tarde a escrever sua tese de doutoramento, "Recherches sur la théorie des quanta". Nesta, de Broglie introduz a sua teoria de ondas de elétrons, que inclui a teoria de dualidade onda-corpúsculo da matéria, baseada na teoria dos quanta proposta por Max Planck e Albert Einstein. Este trabalho abre uma nova área da física, a mecânica ondulatória, que constitui uma das principais bases da mecânica quântica. Em 1927, Clinton Davisson e Lester Germer demonstram experimentalmente a difracção de electrões através de cristais. A experiência de Davisson-Germer comprova a hipótese da natureza ondulatória de electrão e em consequência de Broglie recebe o Nobel de Física em 1929, pela teoria da dualidade onda-corpúsculo. Entre as aplicações mais importantes desta teoria destaca-se o desenvolvimento de microscópios electrónicos, que permitem uma resolução muito superior à dos microscópios ópticos.
 (Würzburg, 5 de Dezembro de 1901 — Munique, 1 de Fevereiro de 1976) foi um físico teórico alemão que recebeu oPrêmio Nobel de Física em 1932 "pela criação da mecânica quântica, cujas aplicações levaram à descoberta, entre outras, das formasalotrópicas do hidrogênio".
(Würzburg, 5 de Dezembro de 1901 — Munique, 1 de Fevereiro de 1976) foi um físico teórico alemão que recebeu oPrêmio Nobel de Física em 1932 "pela criação da mecânica quântica, cujas aplicações levaram à descoberta, entre outras, das formasalotrópicas do hidrogênio".
Para efetuarmos qualquer tipo de medição precisamos interagir com aquilo que queremos medir. Durante a medida do tamanho de um tecido por exemplo, é necessário tocá-lo e compará-lo com uma fita métrica; para medir a velocidade de um carro, o radar rodoviário emite ondas que atingem o carro e voltam permitindo calcular sua velocidade; para simplesmente descobrirmos a posição de qualquer objeto, geralmente precisamos enxergá-lo e se o enxergamos significa que a luz iluminiu este corpo e chegou aos nossos olhos.
Acreditava-se que se soubermos a posição inicial e o momento(massa e velocidade) do corpo, seríamos capazes de prever como ele se comportará. Imagine um jogo de bilhar. Se conhecermos a massa, a velocidade e a posição inicial da bola, podemos calcular o que vai acontecer no jogo.
Quando começamos a lidar com corpos muito pequenos, como os elétrons por exemplo, determinar valores como posição e momento torna-se uma tarefa um pouco mais complicada. Como saber a posição de um elétron? Poderíamoslançar contra ele um feixe de luz com alguns fótons(partículas de luz) e ao recebê-los novamente calcular onde estava.
Ele então notou que a maior parte dessas partículas atravessava a lâmina, e pouquíssimas eram repelidas ou desviadas.
 O motivo de algumas partículas serem repelidas é que bateram de frente com o núcleo atômico do ouro. As que sofreram desvio passaram muito perto do núcleo, pois a partícula alfa é de carga positiva, e o núcleo do ouro também.
O motivo de algumas partículas serem repelidas é que bateram de frente com o núcleo atômico do ouro. As que sofreram desvio passaram muito perto do núcleo, pois a partícula alfa é de carga positiva, e o núcleo do ouro também.
Assim, a Experiência de Rutherford provou que o átomo possui um grande vazio, um espaço muito grande entre os elétrons e os prótons do núcleo.
Niels Bohr
Bohr nasceu em 7 de outubro de 1885 em Copenhaga, Dinamarca.2 Seu pai, Christian Bohr, foi professor de fisiologia na Universidade de Copenhaga (que possui o nome em homenagem ao Efeito de Bohr). Enquanto sua mãe, Ellen Adler Bohr, (nome de solteira Adler) vei o uma rica e proeminente família judia.3 Apesar de ter um fundo religioso, mais tarde renunciou a sua adesão a partir da Igreja Luterana4 e se tornou um ateu.5 Seu irmão era Harald Bohr, foi um matemático e jogador de futebol olímpico que jogou na Seleção Dinamarquesa de Futebol. Niels Bohr também foi um jogador de futebol apaixonado, e os dois irmãos tiveram um número de partidas para o time de Copenhaga Akademisk Boldklub, com Niels no gol.
Seu avô paterno, Henrik Georg Christian Bohr, foi um professor, teólogo e historiador dinamarquês.6 Sua avó paterna se chamava Augusta Louise Caroline Rimestad.6 Seu irmão, o matemático Harald Bohr,1 iniciou o estudo das funções quase-periódicas. Um dos seus filhos, Aage Niels Bohr, ganhou o prêmio Nobel de Física em 1975.1
Bohr casou com Margrethe Nørlund, com quem teve seis filhos, dois dos quais não sobreviveram. Seus filhos sobreviventes foram Hans Henrik (médico), Erik (engenheiro elétrico), Aage (físico) e Ernest (advogado).1
Árvore genealógica baseada no artigo do site do prêmio Nobel e no Dansk biografisk lexicon. Outros cinco filhos de Niels, e possivelmente irmãos, foram omitidos por simplificação
Henrik Georg Christian Bohr
Augusta Louise Caroline Rimestad
Christian Bohr
Ellen (Adler) Bohr
Niels Bohr
Harald Bohr
Margrethe Nørlund Bohr
Hans Henrik Bohr
Erik Bohr
Aage Niels Bohr
Ernest Bohr
| Henrik Georg Christian Bohr | Augusta Louise Caroline Rimestad | ||||||||||||||||||||||||||||||||||||||||||||
| Christian Bohr | Ellen (Adler) Bohr | ||||||||||||||||||||||||||||||||||||||||||||
| Niels Bohr | Harald Bohr | Margrethe Nørlund Bohr | |||||||||||||||||||||||||||||||||||||||||||
| Hans Henrik Bohr | Erik Bohr | Aage Niels Bohr | Ernest Bohr | ||||||||||||||||||||||||||||||||||||||||||
O modelo do átomo de Bohr discutido classicamente
Consideremos o átomo de hidrogênio, que possui um próton e um elétron, conforme mostra a figura 01.
Figura 01: o átomo de hidrogênio em seu estado fundamental
Fc = m.v²/r
Onde
r é o raio da órbita do elétron.
A força de atração eletrostática (coulombiana) é dada por:
Fe = -k.e²/r²
Ou
Fe = -(1/4.πε0).e²/r²
Para um átomo neutro, com mais de um próton, onde o número de prótons é igual ao número de elétrons a equação fica multiplicada pelo fator Z, de modo que obtemos:
Fe = -(1/4.πε0).Z.e²/r²
Fc + Fe = 0
m.v²/r + (- (1/4.πε0).e²/r²) = 0
m.v²/r = (1/4.πε0).e²/r²
v=e/(4.π.ε0.m.r)1/2
A energia (de ligação) total do elétron é igual a soma da energia cinética com a energia potencial eletrostática, que equivale a:
E = mv²/2 + [- e²/(4.πε0.r)]
Substituindo v nesta equação, obtemos:
E = m[e/(4.πε0.mr)1/2]² /2 - e²/(4.πε0.r)
E = m.e²/[(4.πε0.mr).2] - e²/(4.πε0.r)
E = e²/(8.πε0.r) - e²/(4.πε0.r)
E = - e²/(8.πε0.r)
Para um átomo com Z prótons, teremos:
E = - Z.e²/(8.π.ε0.r)
Os raios das órbitas permitidas são:
r = n².h².ε0/π.me.Z.e²
Ou
r = n².a0/Z
Onde
a0 = 5,2917x10-11m, que é denominado raio de Bohr, que é aproximado por 5,3x10-11m.
A energia de ligação também pode ser expressa assim:
E = - (me.e4.Z²)/(8.ε0².h².n²)
O raio de Bohr também pode ser obtido considerado que a enegia de ligação do elétron com o núcleo é de 13,6eV (1eV = 1,6x10-19J), é possível determinar o raio de Bohr para o átomo de hidrogênio, e obter o valo de 5,3x10 -11m.
Estes postulados estabelecem uma coerência entre o modelo atômico com a teoria clássica do eletromagnetismo:
- O elétron pode se mover em determinadas órbitas sem irradiar. Estas órbitas estáveis constituem os denominados estados estacionários.
- O momento angular do elétron em torno do núcleo atômico é igual a um múltiplo inteiro de h/2π, ou seja:
L = m.v.r
m.v.r = n.h/2. π
Onde n é um número inteiro, o número quântico, que pode ser 1, 2, 3, 4, ... .
- O elétron irradia energia quando salta de sua órbita para uma órbita mais interna.
Figura 02: o elétron passa de seu estado excitado para o estado fundamental, para uma órbita mais interna.
A energia irradiada é dada por:
E = Ei - Ef
Onde
E é a energia,
Ei é a energia antes da transição e
Ef é a energia depois da transição.
Esta mesma equação pode ser assim expressa:
E = h.f
Onde
h é a constante de Planck, que vale 6,63x10-34J.s;
f é freqüência da radiação emitida;
É possível deduzir uma expressão para determinar a freqüência da radiação emitida, a partir das últimas quatro expressões, de modo que obteremos:
f = (m.e4 / 8.ε0².h³)[(1/nf²) – (1/ni²)]
Se
λ = c/f
obtém-se
1/λ = (m.e4 / 8ε0².c.h³).[(1/nf²) – (1/ni²)]
E podemos mostrar que a constante de Rydberg é dada por:
R = m.e4/8.ε0².c.h³
REFERÊNCIAS BIBLIOGRÁFICAS:
EISBERG, Robert RESNICK, Robert. Física Quântica – Átomos, Moléculas, Sólidos, Núcleos e Partículas. Tradução de Paulo Costa Ribeiro, Ênio Costa da Silveira e Marta Feijó Barroso. Rio de Janeiro:Campus, 1979
Erwin Schrödinger
Schrödinger nasceu em 1887 em Viena, Áustria, filho de Rudolf Schrödinger (produtor de mortalhas e botânico) e Georgine Emilia Brenda (filha de Alexander Bauer, professor de Química na Universidade de Tecnologia de Viena).
Sua mãe era metade austríaca e metade inglesa. O lado inglês de sua família veio de Leamington Spa. Schrödinger aprendeu inglês e alemão quase ao mesmo tempo, devido ao fato de que ambos eram falados na sua família. Seu pai era católico e sua mãe, luterana.
Em 1898, frequentou o Akademisches Gymnasium em Viena, e entre 1906 e 1910 estudou em Viena como aluno de Franz Serafin Exner (1849 - 1926) e Friedrich Hasenöhrl (1874 - 1915). Também realizou trabalhos experimentais com Karl Wilhelm Friedrich Kohlrausch.3
Em 1911, Schrödinger tornou-se assistente de Exner. Em uma idade precoce, foi fortemente influenciado por Schopenhauer.4 Como resultado de sua leitura extensiva das obras de Schopenhauer, tornou-se profundamente interessado por toda a sua vida na teoria da cor, filosofia,5 percepção e religião oriental, principalmente a hindu Vedanta.
Vida adulta [editar]
Em 1914, Erwin Schrödinger obteve a habilitação (venia legendi, equivalente ao doutorado). Entre 1914 e 1918 participou do esforço da guerra como um funcionário comissionado na artilharia em fortalezas austríacas (Gorizia, Duino, Sistiana, Prosecco, Viena). Em 6 de abril de 1920, casou-se com Annemarie Bertel. No mesmo ano, tornou-se assistente de Max Wien, em Jena, e em setembro de 1920 alcançou a posição daAusserordentlicher Professor, aproximadamente o equivalente a professor adjunto, em Stuttgart. Em 1921, tornou-se Ordentlicher Professor, ou seja, professor titular, na Universidade de Breslau (atual Wrocław, Polônia).
Em 1921, transferiu-se para a Universidade de Zurique. Em janeiro de 1926, Schrödinger publicou no Annalen der Physik o trabalho "Quantisierung als Eigenwertproblem" (Quantização como um Problema de Autovalor) em mecânica de ondas e que hoje é conhecido como aequação de Schrödinger. Neste trabalho ele deu uma "derivação" da equação de onda para sistemas independentes de tempo, e mostrou que fornecia autovalores de energia corretos para o átomo hidrogenoide. Este trabalho tem sido universalmente considerado como uma das conquistas mais importantes do século XX, criando uma revolução na mecânica quântica, e na verdade em toda a física e a química. Um segundo documento foi apresentado apenas quatro semanas depois e que resolveu o oscilador harmônico quântico, o rotor rígido e a molécula diatômica, e dá uma nova derivação da equação de Schrödinger. Um terceiro documento em maio mostrou a equivalência da sua abordagem à deHeisenberg e deu o tratamento do efeito Stark. Um quarto trabalho de sua série mais marcante mostrou como tratar os problemas nos quais o sistema muda com o tempo, como nos problemas de dispersão. Estes trabalhos foram os principais de sua carreira e foram imediatamente reconhecidos como tendo grande importância pela comunidade científica.
Louis de Broglie
 Louis de Broglie estudou inicialmente história, depois interessou-se por física e matemática, por influência de seu irmão, Maurice de Broglie, 6º duque de Broglie e proeminente físico experimental da época. Louis de Broglie iniciou seus trabalhos de pesquisa estudando os raios X, em colaboração com Maurice. Foi este trabalho que o levou mais tarde a escrever sua tese de doutoramento, "Recherches sur la théorie des quanta". Nesta, de Broglie introduz a sua teoria de ondas de elétrons, que inclui a teoria de dualidade onda-corpúsculo da matéria, baseada na teoria dos quanta proposta por Max Planck e Albert Einstein. Este trabalho abre uma nova área da física, a mecânica ondulatória, que constitui uma das principais bases da mecânica quântica. Em 1927, Clinton Davisson e Lester Germer demonstram experimentalmente a difracção de electrões através de cristais. A experiência de Davisson-Germer comprova a hipótese da natureza ondulatória de electrão e em consequência de Broglie recebe o Nobel de Física em 1929, pela teoria da dualidade onda-corpúsculo. Entre as aplicações mais importantes desta teoria destaca-se o desenvolvimento de microscópios electrónicos, que permitem uma resolução muito superior à dos microscópios ópticos.
Louis de Broglie estudou inicialmente história, depois interessou-se por física e matemática, por influência de seu irmão, Maurice de Broglie, 6º duque de Broglie e proeminente físico experimental da época. Louis de Broglie iniciou seus trabalhos de pesquisa estudando os raios X, em colaboração com Maurice. Foi este trabalho que o levou mais tarde a escrever sua tese de doutoramento, "Recherches sur la théorie des quanta". Nesta, de Broglie introduz a sua teoria de ondas de elétrons, que inclui a teoria de dualidade onda-corpúsculo da matéria, baseada na teoria dos quanta proposta por Max Planck e Albert Einstein. Este trabalho abre uma nova área da física, a mecânica ondulatória, que constitui uma das principais bases da mecânica quântica. Em 1927, Clinton Davisson e Lester Germer demonstram experimentalmente a difracção de electrões através de cristais. A experiência de Davisson-Germer comprova a hipótese da natureza ondulatória de electrão e em consequência de Broglie recebe o Nobel de Física em 1929, pela teoria da dualidade onda-corpúsculo. Entre as aplicações mais importantes desta teoria destaca-se o desenvolvimento de microscópios electrónicos, que permitem uma resolução muito superior à dos microscópios ópticos.
No final da sua carreira, de Broglie desenvolveu uma explicação causal da mecânica ondulatória, em oposição à visão probabilística, que domina a mecânica quântica. Esta explicação causal foi refinada no anos 1950 por David Bohm e é hoje conhecida como interpretação de Bohm.
Participou da 5ª e 7ª Conferência de Solvay.
Físico e professor francês, nascido em Dieppe, príncipe e depois sétimo duque de Broglie, que estabeleceu uma correspondência entre onda e partícula e formulou a mecânica ondulatória. Descendente de família aristocrática de ricos e nobres italianos de Piemonte, radicados na França (1640), de ilustres militares, políticos e diplomatas, formou-se em Licenciatura em História (1910) e logo depois cursou um ano de Direito.
Mas a grande repercussão que alcançavam na época as grandes transformações na Física, fez com que seguisse seu irmão Maurice Broglie (1875-1960), 17 anos mais velho, que rompera com essa tradição familiar e dedicara-se a física. Maurice incentivou-o a ler os trabalhos de Jules Henri Poincaré (1854-1912), que tratavam da aplicação da análise matemática aos problemas da astronomia e a certos fenômenos físicos do mundo macroscópico.
Com o irmão como secretário do 1º Congresso Solvay (1911), que contou com a presença dos maiores especialistas em física de todo o mundo, ele também teve a rara oportunidade de ler as cópias recém-impressas dos últimos trabalhos e estudos de Max Karl Ernst Ludwig Planck (1858-1947) e Albert Einstein (1879-1955) e tomar, então, conhecimento das primeiras teorias quânticas e relativísticas. Estes trabalhos iniciais demonstravam a insuficiência das teorias clássicas para a explicação de novos fenômenos descobertos e a necessidade de introduzir o conceito de quantum de luz. Seu entusiasmo foi tão grande que se decidiu imediatamente pela carreira de físico, largando seus estudos de história.
Assim, estimulado por estes novos conceitos, procurou avidamente uma base racional para essa nova maneira de estudar a luz. Licenciado em ciências físicas, durante a Primeira Guerra Mundial foi engajado e passou a trabalhar no serviço de radiotelegrafia do exército francês, período em que aprimorou seus estudos sobre o eletromagnetismo. Após a primeira Guerra Mundial continuou trabalhando em física teórica no laboratório do irmão Maurice, na pesquisa da estrutura da matéria, utilizando raios X. Nestas condições, conseguiu amadurecer as idéias revolucionárias que seriam expostas em sua tese de doutoramento.
Defendeu sua tese de doutorado na Sorbonne, Recherches sur la théorie des quanta (1924), resultado de uma pesquisa sobre a teoria dos quanta, formulação que marcou o surgimento da mecânica ondulatória, o movimento ondulatório das partículas, associando os princípios da mecânica clássica aos da óptica e, assim, possibilitando a invenção do microscópio eletrônico (1927). Para formular sua teoria, ele fez a seguinte analogia: se a natureza havia demonstrado ser essencialmente simétrica, por exemplo, existindo cargas positivas e negativas, frio e calor etc e, além disso, o universo observável era composto inteiramente de matéria e energia, como luz, raios cósmicos etc, e se a luz tinha um comportamento ao mesmo tempo de onda e de partícula, talvez o mesmo acontecesse com a matéria. Fisicamente sua teoria associava a qualquer partícula em movimento um comprimento de onda dado pela expressão l= h / mv, onde aparece a constante de Planck h, a massa da partícula m e sua velocidade escalar v.
Recebida inicialmente com reservas, a prova experimental da teoria ondulatória da matéria seria feita quatro anos após a publicação de sua tese de doutoramento, através da experiência decisiva dos físicos americanos Clinton Joseph Davisson (1881-1958), também um Nobel (1937), e Lester Halbert Germer (1896-1971). Nomeado professor (1928) do Instituto Henri Poincaré, Universidade de Sorbonne, Paris, ganhou o Prêmio Nobel de Física (1929) pela descoberta do comportamento ondulatório dos elétrons, tornando-se, aos 37 anos de idade, um dos mais jovens membros da galeria dos prêmios Nobel.
Ganhou o Prêmio Kalinga, concedido pela UNESCO (1952). Admitido como Membro da Academia de Ciências (1933) e da Academia Francesa de Letras por seu talento como escritor (1944), também publicou importantes trabalhos sobre física teórica, história e filosofia das ciências, como Introduction à l'étude de la mécanique ondulatoire (1930), traduzidos para o inglês como An Introduction to the Study of Wave Mechanics (1930), Revolution in Physics (tr. 1953) e Non-Linear Wave Mechanics (tr. 1960) e Certitudes et incertitudes de la science (1966) e morreu em Paris.
Werner Heisenberg
 (Würzburg, 5 de Dezembro de 1901 — Munique, 1 de Fevereiro de 1976) foi um físico teórico alemão que recebeu oPrêmio Nobel de Física em 1932 "pela criação da mecânica quântica, cujas aplicações levaram à descoberta, entre outras, das formasalotrópicas do hidrogênio".
(Würzburg, 5 de Dezembro de 1901 — Munique, 1 de Fevereiro de 1976) foi um físico teórico alemão que recebeu oPrêmio Nobel de Física em 1932 "pela criação da mecânica quântica, cujas aplicações levaram à descoberta, entre outras, das formasalotrópicas do hidrogênio".
Juntamente com Max Born e Pascual Jordan, Heisenberg estabeleceu as bases da formulação matricial da mecânica quântica em 1925. Em 1927, publicou o artigo Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik, em que apresenta o Princípio da incerteza. Também fez importantes contribuições teóricas nos campos da hidrodinâmica de escoamentos turbulentos, no estudo do núcleo atômico, do ferromagnetismo, dos raios cósmicos e das partículas subatômicas. Teve ainda uma contribuição fundamental no planejamento do primeiro reator nuclear alemão em Karlsruhe e de um reator de pesquisa em Munique, em 1957. Muitas controvérsias envolvem o seu trabalho na pesquisa nuclear durante a Segunda Guerra Mundial.
Após a guerra, foi nomeado diretor do Instituto Kaiser Wilhelm de Física, que mais tarde passou a ser denominado Instituto Max Planck de Física. Ele dirigiu o instituto até sua transferência para Munique em 1958, quando foi ampliado e renomeado Instituto Max Planck de Física e Astrofísica. Heisenberg foi ainda presidente do Conselho de Pesquisa Alemão, presidente da Comissão de Física Atômica, presidente do Grupo de Física Nuclear de Trabalho, e presidente da Fundação Alexander von Humboldt.
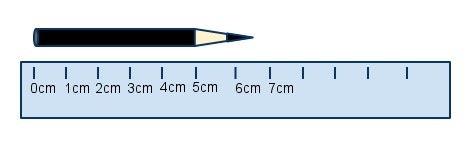
Por melhor que sejam os nossos aparelhos de medição, sempre haverá uma possível diferença entre a medida que avaliamos e a medida real. Por exemplo, se usarmos uma régua graduada em apenas em centímetros, nunca teremos certeza sobre os milímetros daquela medida. A possível diferença entre o valor que medimos e o valor real é chamada de incerteza.
Quanto mede o lápis acima? Se dissermos 6,5 cm não podemos ter certeza sobre os 0,5 cm além dos 6 cm marcados na régua. Não existe qualquer indicação na régua que mostre esses 0,5 cm a mais. Por isso dizemos que a incerteza dessa medida é + 0,5 cm.
Momento ou Quantidade de Movimento
Na Mecânica Clássica aprendemos que a quantidade de movimento(P) é o produto da velocidade(V) pela massa(m) de um determinado objeto:
P = m x V
A idéia parece correta, desde que possamos realmente calcular estes valores com a precisão necessária.
Princípio da Incerteza de Heisenberg
O Princípio da Incerteza
Se tentarmos porém determinar a quantidade de movimento da mesma forma, alteraremos a quantidade de movimento original com os fótons que lançamos. Podemos então criar uma cuidadosa experiência para tentar calcular o momento do elétron. A Quantidade de Movimento da partícula necessária para esse cálculo muda a posição do elétron de modo que não conseguimos descobrir a posição com boa precisão. Resumindo, quanto maior a precisão com que medimos a posição menor a precisão com que mediremos o momento e vice-versa. A isso chamamos de Princípio da Incerteza de Heisenberg.
Essa incerteza não se deve aos aparelhos que usamos, mas a própria natureza das partículas. Segundo as leis da Mecânica Quântica, quanto mais fácil for para encontrar uma partícula maior o momento necessário para interagir com ela, o que torna mais difícil determinar a sua Quantidade de Movimento. Algo parecido ocorre se conseguirmos determinar o Momento com precisão e tentarmos descobrir a posição.
Como podemos perceber, muitos conceitos da Mecânica Quântica são bastante diferentes da Mecânica Clássica. Porém a maior parte da Ciência desenvolvida antes do século XX encontra aplicações em nossa vida diária e nas situações com que estamos acostumados. Esta mesma Ciência Clássica começa a perder sua utilidade quando estudamos objetos extremamente pequenos, como átomos, extremamente grandes, como estrelas ou estremamente rápidos, próximos da velocidade da luz.
Fontes:
A estrutura quântica da matéria - do átomo pré-socrático às partículas elementares. José Leite Lopes - UFRJ Editora/Academia Brasileira de Ciências/ERCA-Editora e Gráfica limitada - Rio de Janeiro
A estrutura quântica da matéria - do átomo pré-socrático às partículas elementares. José Leite Lopes - UFRJ Editora/Academia Brasileira de Ciências/ERCA-Editora e Gráfica limitada - Rio de Janeiro
Integrantes: Sandro Dalla Bernadina, Daniel Damaceno, Indionara Dos Santos
Serie: 1ºF M6




Nenhum comentário:
Postar um comentário